Этиология
Антифосфолипидные антитела
АФА представляют собой семейство из, более чем, 20 видов аутоантител. Первоначально считалось, что действие АФА направлено непосредственно на анионные фосфолипиды (ФЛ), однако, в дальнейшем было выяснено, что данные антитела образуются не к самим фосфолипидам, а к различным белкам, способным связываться с фосфолипидами, главным образом к β2 -гликопротеину-1 (β2GPI).
Многие бактериальные инфекции сопровождаются повышенным синтезом антифосфолипидных антител, и, в редких случаях, клиническими проявлениями АФС. Данные антитела синтезируются В-лимфоцитами как реакция на представляемые возбудителем инфекции эпитопы. Другие факторы, такие как применение некоторых лекарственных препаратов или наличие онкологического заболевания, также могут быть связаны с увеличением количества антифосфолипидных антител.
Согласно другой гипотезе, синтезируемые, в ответ на инфекционный процесс, антитела становятся патогенными при определенных неблагоприятных условиях, таких как оксидативный стресс. Отмечается, что антифосфолипидные антитела присутствуют у 12% пожилых пациентов и у 2% пациентов молодого возраста.
Генетика и АФС
Присутствие антифосфолипидных антител связано, по крайней мере частично, с генетической предрасположенностью (система HLA). Кроме того, предполагается наличие связи между определенными полиморфизмами гена β2-GPI (Val / Leu 247) и развитием АФС.
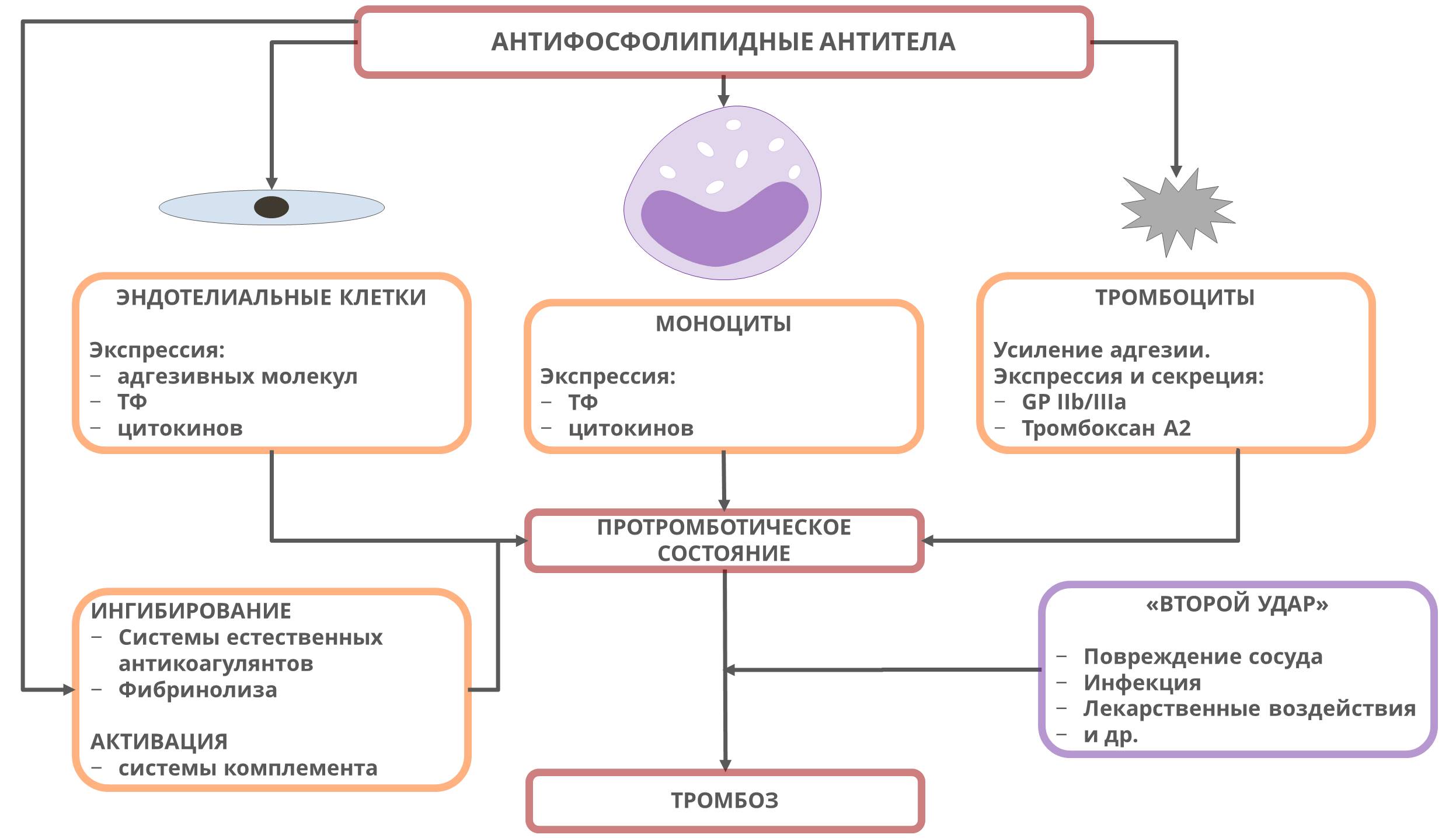
Патогенетическая роль антифосфолипидных антител
β2GPI является белком плазмы, физиологическая роль которого не до конца изучена. Он связывается с отрицательно заряженными фосфолипидами, такими как кардиолипин, фосфатидилсерин и фосфатидилинозитол. При связывании с фосфолипидами β2GPI изменяет свою конформацию, в результате чего происходит презентация эпитопа, с которым могут связываться антитела.
К патогенетическим факторам, ассоциированным с присутствием АФА и приводящим к развитию протромботических состояний, относятся:
- Снижение активности системы протеина С путем ингибирования активации протеина С, а также его способности инактивировать ф.VIII и ф.V.
- Ингибирование процессов связывания антитромбина с гепарином
- Ингибирование активности TFPI
- Нейтрализация способности β2GPI стимулировать активность tPA, что приводит к снижению активности фибринолиза
- Ослабление способности β2GPI ингибировать VWF-зависимую агрегацию тромбоцитов и активацию комплемента.
Присутствие АФА и, в особенности, антител к β2GPI приводит к активации клеточных элементов сосудистого русла:
- Активация эндотелиальных клеток приводит к изменениям, в результате которых интактная сосудистая стенка начинает проявлять прокоагулянтные свойства: экспрессия адгезивных молекул (E-селектин, VCAM-1, ICAM-1), фактора Виллебранда, тканевого фактора, провоспалительных цитокинов, а также высвобождение микрочастиц с провоспалительными и прокоагулянтными свойствами.
- Данные научных публикаций указывают на то, что АФА-опосредованная активация моноцитов приводит, как и в случае с эндотелиальными клетками, к экспресии тканевого фактора и выработке провоспалительных цитокинов.
- Активация нейтрофилов в присутствии АФА приводит к высвобождению нейтрофильных внеклеточных ловушек (NETS).
- Механизм воздействия АФА на тромбоциты не до конца изучен. В присутствии АФА отмечается усиление адгезии тромбоцитов к коллагену (в условиях тока крови) и их активации (с экспрессией GP IIb/IIIa и секрецией тромбоксана А2) в присутствии крайне малых количеств тромбина.
На основании ряда научных исследований и клинических наблюдений была разработана теория «двойного удара». «Первый удар» наносят АФА путем воздействия на клеточные элементы, ингибирования системы естественных антикоагулянтов и компонентов фибринолиза, что приводит к развитию прокоагулянтного состояния.
«Вторым ударом» может являться некий внешний стимул, проявляющийся повреждением стенки сосуда, инфекцией и/или воспалением, что в итоге приводит к развитию эпизода тромбообразования. В некоторых случаях АФА может выступать в роли «второго удара» у пациентов уже имеющих склонность к повышенной свертываемости крови (прием комбинированных оральных контрацептивов, ожирение, наследственная тромбофилия и др.).
Литература:
Chaturvedi, S., & McCrae, K. R. (2017). Diagnosis and management of the antiphospholipid syndrome. Blood reviews, 31(6), 406–417. https://doi.org/10.1016/j.blre.2017.07.006