Осложнения заболевания
Наиболее тяжелым осложнением ТГВ, нередко приводящим к летальному исходу, является тромбоэмболия легочной артерии (ТЭЛА). В 90% случаев “источником” ТЭЛА являются тромбы, образованные в системе глубоких вен нижних конечностей, таза, почек и нижней полой вене. Механизм развития ТЭЛА заключается в отрыве флотирующего тромба (при изменении гемодинамики вследствие кашля, ходьбы и др.) с последующей его миграцией в легочную артерию и развитием полной или частичной окклюзии артерий различного диаметра. В зависимости от тяжести процесса ТЭЛА подразделяют на массивную (окклюзия более половины легочного кровотока), субмассивную (окклюзия 30-50% легочного русла) и тромбоэмболию мелких ветвей легочных артерий (окклюзия <30% артериального русла).
Клинические признаки ТЭЛА разнообразны, неспецифичны и зависят, в том числе, от размеров и локализации эмбола:
- боль в груди
- одышка
- кашель, кровохарканье
- цианоз
- субфебрильная температура
- стойкая артериальная гипотензия или шок
- тахикардия
- правосторонняя сердечная недостаточность
- плеврит.
В приблизительно 50% случаев первичный эпизод формирования тромба протекает без выраженной клинической картины и может остаться не диагностированным. В подобных случаях клинические проявления ТЭЛА являются первым признаком состоявшегося ТГВ с дальнейшей эмболизацией легочного кровотока.
Алгоритм диагностики ТЭЛА повторяет алгоритм диагностики ТГВ, однако используется специальная шкала Wells для оценки вероятности ТЭЛА и другой перечень визуализирующих исследований - КТ с контрастированием легочных артерий, вентиляционно-перфузионная сцинтиграфия легких, компрессионная ультрасонография вен нижних конечностей.
Значения отрицательной прогностической значимости (NPV%) измерения уровня D-димера определяются отдельно для ТГВ и для ТЭЛА.
Оценка вероятности ТЭЛА по клиническим данным: индекс Wells
Вероятность ТЭЛА по клиническим данным
- Низкая 0—1 балл
- Средняя 2—6 баллов
- Высокая ≥7 баллов
Другим осложнением ТГВ является посттромботическая болезнь (ПТБ). Механизм развития ПТБ заключается в затруднении оттока крови из нижней конечности в связи с утолщением и ригидностью стенок сосудов, разрушением клапанных структур глубоких вен и другими изменениями в сосудистом русле. Последующее усиление коллатерального кровотока и расширение просвета подкожных вен приводят к развитию симптомокомплекса, включающего:
- отек нижней конечности, обычно постоянный
- варикозное расширение подкожных вен
- боль, тяжесть и утомляемость пораженной конечности
- патологические процессы, связанные с нарушением трофики кожи и развитием трофических язв.
Рецидивы.
Более высокий риск развития рецидива ВТЭО наблюдается при сохранении фактора/ов риска, приведшего к формированию и отрыву тромба (напр. злокачественное новообразование) чем при его транзиторном характере. Для снижения риска рецидива ВТЭО показано длительное использование антикоагулянтов. Подходы к их применению для лечения и длительной вторичной профилактики ТГВ и ТЭЛА представлены в соответствующих клинических рекомендациях (например, Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО)).
Присутствие тромбофилии, ассоциированной с высоким риском рецидива (АФС, дефицит PC или PS, мутации фактора V Лейден или протромбина G20210A), а также повышенный уровень D-димера на фоне АКТ (или его повышение через 1 месяц после отмены АКТ) являются одними из оснований для продления АКТ после впервые возникшего неспровоцированного эпизода проксимального ТГВ/ТЭЛА.
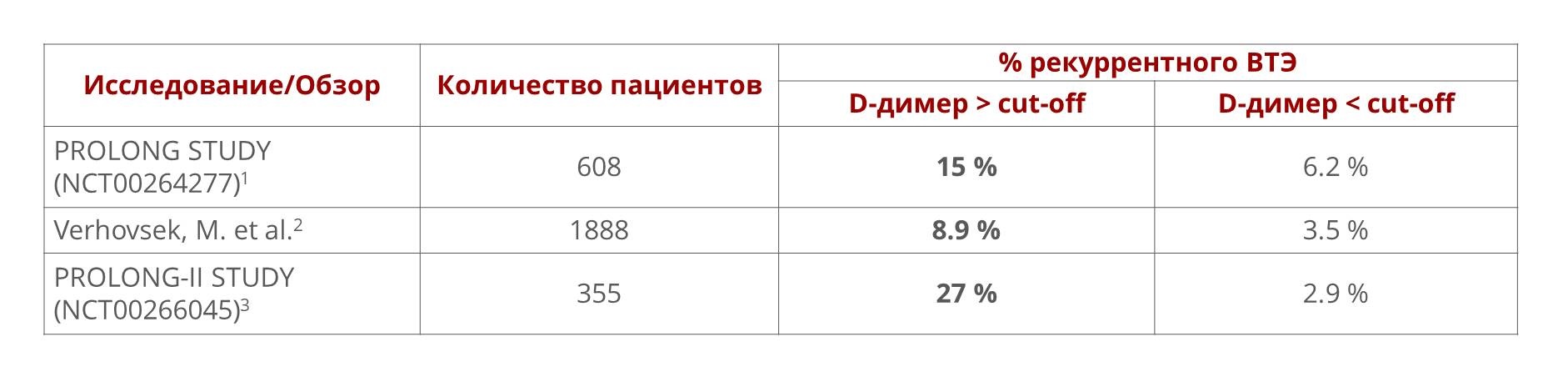
В зарубежных исследованиях также отмечена важная роль концентрации D-димера как прогностического маркера рекуррентного ВТЭ. Опубликованные данные описывают существенное повышение риска рекуррентного ВТЭ при выявлении концентраций D-димера > cut-off во время или через 1 месяц после окончания АКТ у пациентов, перенесших впервые возникший эпизод неспровоцированного ВТЭ:
Литература:
Андрияшкин А.В., Андрияшкин В.В., Арутюнов Г.П., и др. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО). Флебология. 2015;2:1-52.
1Palareti, G., Cosmi, B., Legnani, C., Tosetto, A., Brusi, C., Iorio, A., Pengo, V., Ghirarduzzi, A., Pattacini, C., Testa, S., Lensing, A. W., Tripodi, A., & PROLONG Investigators (2006). D-dimer testing to determine the duration of anticoagulation therapy. The New England journal of medicine, 355(17), 1780–1789. https://doi.org/10.1056/NEJMoa054444
2Verhovsek, M., Douketis, J. D., Yi, Q., Shrivastava, S., Tait, R. C., Baglin, T., Poli, D., & Lim, W. (2008). Systematic review: D-dimer to predict recurrent disease after stopping anticoagulant therapy for unprovoked venous thromboembolism. Annals of internal medicine, 149(7), 481–W94. https://doi.org/10.7326/0003-4819-149-7-200810070-00008
3Cosmi, B., Legnani, C., Tosetto, A., Pengo, V., Ghirarduzzi, A., Testa, S., Prisco, D., Poli, D., Tripodi, A., Marongiu, F., Palareti, G., & PROLONG Investigators (on behalf of Italian Federation of Anticoagulation Clinics) (2010). Usefulness of repeated D-dimer testing after stopping anticoagulation for a first episode of unprovoked venous thromboembolism: the PROLONG II prospective study. Blood, 115(3), 481–488. https://doi.org/10.1182/blood-2009-08-237354